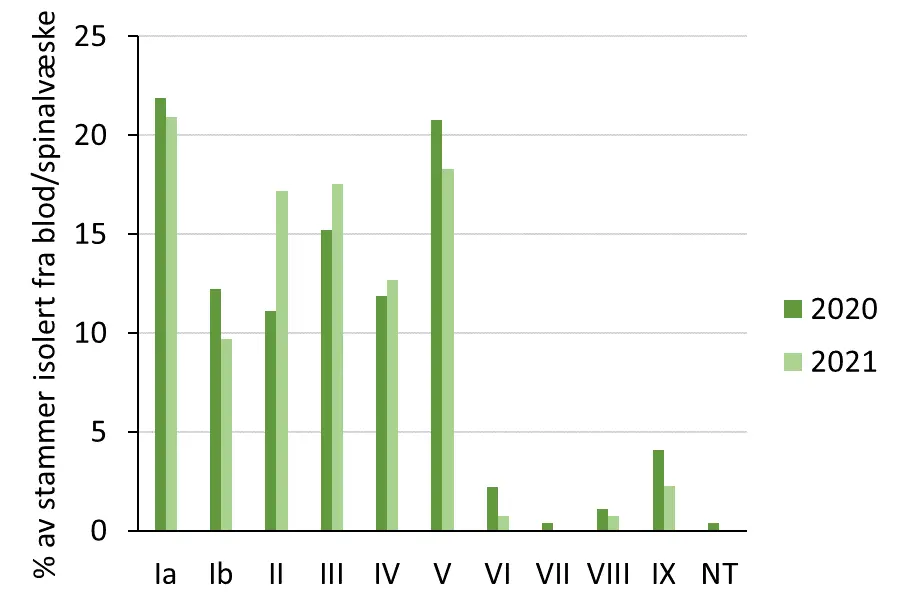
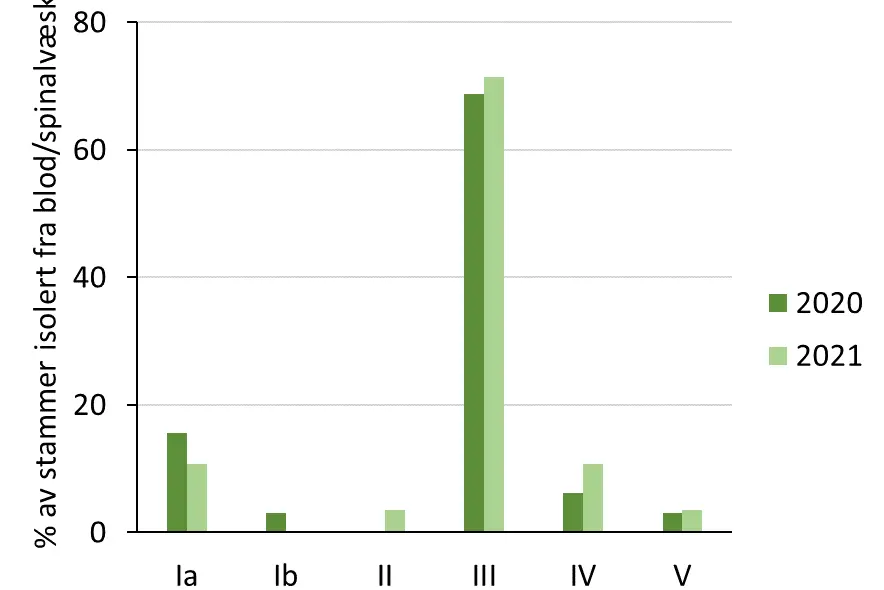
2020-2022
1. Basson, A., et al., The Streptococcus agalactiae R3 surface protein is encoded by sar5. PLoS One, 2022. 17(7): p. e0263199.
2. Mynarek, M., et al., Incidence of invasive Group B Streptococcal infection and the risk of infant death and cerebral palsy: a Norwegian Cohort Study. Pediatr Res, 2021. 89(6): p. 1541-1548.
2010-2019
3. Moen, S.H., et al., Human Toll-like Receptor 8 (TLR8) Is an Important Sensor of Pyogenic Bacteria, and Is Attenuated by Cell Surface TLR Signaling. Front Immunol, 2019. 10: p. 1209.
4. Gabrielsen, C., et al., Molecular characteristics of Streptococcus agalactiae strains deficient in alpha-like protein encoding genes. J Med Microbiol, 2017. 66(1): p. 26-33.
5. Gabrielsen, C., et al., Characterization of the virulence potential of Staphylococcus condimenti isolated from a patient with severe soft tissue infection. New Microbes New Infect, 2017. 18: p. 8-14.
6. Maeland, J.A., et al., Survey of immunological features of the alpha-like proteins of Streptococcus agalactiae. Clin Vaccine Immunol, 2015. 22(2): p. 153-9.
7. Brigtsen, A.K., et al., Comparison of PCR and serotyping of Group B Streptococcus in pregnant women: the Oslo GBS-study. J Microbiol Methods, 2015. 108: p. 31-5.
8. Maeland, J.A., et al., Novel aspects of the Z and R3 antigens of Streptococcus agalactiae revealed by immunological testing. Clin Vaccine Immunol, 2013. 20(4): p. 607-12.
9. Maeland, J.A. and A. Radtke, Comparison of Z and R3 antigen expression and of genes encoding other antigenic markers in invasive human and bovine Streptococcus agalactiae strains from Norway. Vet Microbiol, 2013. 167(3-4): p. 729-33.
10. Radtke, A., et al., Multiple-locus variant-repeat assay (MLVA) is a useful tool for molecular epidemiologic analysis of Streptococcus agalactiae strains causing bovine mastitis. Vet Microbiol, 2012. 157(3-4): p. 398-404.
11. Kvam, A.I., et al., Streptococcus agalactiae alpha-like protein 1 possesses both cross-reacting and Alp1-specific epitopes. Clin Vaccine Immunol, 2011. 18(8): p. 1365-70.
12. Afshar, B., et al., International external quality assurance for laboratory identification and typing of Streptococcus agalactiae (Group B streptococci). J Clin Microbiol, 2011. 49(4): p. 1475-82.
13. Radtke, A., et al., Rapid multiple-locus variant-repeat assay (MLVA) for genotyping of Streptococcus agalactiae. J Clin Microbiol, 2010. 48(7): p. 2502-8.
14. Mavenyengwa, R.T., J.A. Maeland, and S.R. Moyo, Serotype markers in a Streptococcus agalactiae strain collection from Zimbabwe. Indian J Med Microbiol, 2010. 28(4): p. 313-9.
2000-2009
15. Radtke, A., et al., Identification of surface proteins of group B streptococci: serotyping versus genotyping. J Microbiol Methods, 2009. 78(3): p. 363-5.
16. Mavenyengwa, R.T., J.A. Maeland, and S.R. Moyo, Putative novel surface-exposed Streptococcus agalactiae protein frequently expressed by the group B streptococcus from Zimbabwe. Clin Vaccine Immunol, 2009. 16(9): p. 1302-8.
17. Bergseng, H., et al., Molecular and phenotypic characterization of invasive group B streptococcus strains from infants in Norway 2006-2007. Clin Microbiol Infect, 2009. 15(12): p. 1182-5.
18. Persson, E., et al., Characterisation of invasive group B streptococci based on investigation of surface proteins and genes encoding surface proteins. Clin Microbiol Infect, 2008. 14(1): p. 66-73.
19. Persson, E., et al., Antimicrobial susceptibility of invasive group B streptococcal isolates from south-west Sweden 1988-2001. Scand J Infect Dis, 2008. 40(4): p. 308-13.
20. Mavenyengwa, R.T., J.A. Maeland, and S.R. Moyo, Distinctive features of surface-anchored proteins of Streptococcus agalactiae strains from Zimbabwe revealed by PCR and dot blotting. Clin Vaccine Immunol, 2008. 15(9): p. 1420-4.
21. Bergseng, H., et al., Invasive group B streptococcus (GBS) disease in Norway 1996-2006. Eur J Clin Microbiol Infect Dis, 2008. 27(12): p. 1193-9.
22. Bergseng, H., et al., Real-time PCR targeting the sip gene for detection of group B Streptococcus colonization in pregnant women at delivery. J Med Microbiol, 2007. 56(Pt 2): p. 223-228.
23. Mavenyengwa, R.T., et al., Streptococcus agalactiae (group B streptococcus (GBS)) colonisation and persistence, in pregnancy; a comparison of two diverse communities (rural and urban). Cent Afr J Med, 2006. 52(3-4): p. 38-43.
24. Maeland, J.A., L. Bevanger, and R.V. Lyng, Immunological markers of the R4 protein of Streptococcus agalactiae. Clin Diagn Lab Immunol, 2005. 12(11): p. 1305-10.
25. Skjaervold, N.K., K. Bergh, and L. Bevanger, Distribution of PFGE types of invasive Norwegian group B streptococci in relation to serotypes. Indian J Med Res, 2004. 119 Suppl: p. 201-4.
26. Moyo, S.R. and J.A. Maeland, Recognition of different epitopes on the Ca & R4 proteins of group B streptococci by normal human & antibodies induced in animals. Indian J Med Res, 2004. 119 Suppl: p. 224-7.
27. Maeland, J.A., L. Bevanger, and R.V. Lyng, Antigenic determinants of alpha-like proteins of Streptococcus agalactiae. Clin Diagn Lab Immunol, 2004. 11(6): p. 1035-9.
28. Bergh, K., et al., Detection of group B streptococci (GBS) in vaginal swabs using real-time PCR with TaqMan probe hybridization. Indian J Med Res, 2004. 119 Suppl: p. 221-3.
29. Moyo, S.R. and J.A. Maeland, Antibodies raised in animals against the Streptococcus agalactiae proteins c alpha and R4 and normal human serum antibodies target distinct epitopes. J Med Microbiol, 2003. 52(Pt 5): p. 379-383.
30. Afset, J.E., K. Bergh, and L. Bevanger, High prevalence of atypical enteropathogenic Escherichia coli (EPEC) in Norwegian children with diarrhoea. J Med Microbiol, 2003. 52(Pt 11): p. 1015-1019.
31. Moyo, S.R., J.A. Maeland, and K. Bergh, Typing of human isolates of Streptococcus agalactiae (group B streptococcus, GBS) strains from Zimbabwe. J Med Microbiol, 2002. 51(7): p. 595-662.
32. Moyo, S.R., J.A. Maeland, and E.S. Munemo, Susceptibility of Zimbabwean Streptococcus agalactiae (group B Streptococcus; GBS) isolates to four different antibiotics. Cent Afr J Med, 2001. 47(9-10): p. 226-9.
33. Moyo, S.R., J.A. Maeland, and J. Mudzori, Antibodies against Streptococcus agalactiae proteins c(alpha) and R4 in sera from pregnant women from Norway and Zimbabwe. Clin Diagn Lab Immunol, 2001. 8(6): p. 1110-4.
34. Moyo, S.R., J.A. Maeland, and R.V. Lyng, The putative R1 protein of Streptococcus agalactiae as serotype marker and target of protective antibodies. Apmis, 2001. 109(12): p. 842-8.
35. Moyo, S.R., et al., Prevalence, capsular type distribution, anthropometric and obstetric factors of group B Streptococcus (Streptococcus agalactiae) colonization in pregnancy. Cent Afr J Med, 2000. 46(5): p. 115-20.
36. Maeland, J.A., et al., Distribution and expression of bca, the gene encoding the c alpha protein, by Streptococcus agalactiae. J Med Microbiol, 2000. 49(2): p. 193-198.
1970-1999
37. Moyo, S.R., J.A. Maeland, and L. Bevanger, Comparison of three different methods in monoclonal antibody-based detection of Streptococcus agalactiae protein serotype markers. Apmis, 1999. 107(3): p. 263-9.
38. Maeland, J.A., et al., bca, beta gene, and gene product divergency in reference and prototype strains of streptococcus agalactiae. Clin Diagn Lab Immunol, 1999. 6(6): p. 986-8.
39. Kvam, A.I., L. Bevanger, and J.A. Maeland, Properties and distribution of the putative R3 protein of Streptococcus agalactiae. APMIS, 1999. 107(9): p. 869-74.
40. Maeland, J.A., et al., Streptococcus agalactiae beta gene and gene product variations. J Med Microbiol, 1997. 46(12): p. 999-1005.
41. Lars, B., et al., Aberrations in expression of the beta antigen of Streptococcus agalactiae. Adv Exp Med Biol, 1997. 418: p. 999-1001.
42. Kvam, A.I., et al., Distribution of serovariants of group B streptococci in isolates from England and Norway. J Med Microbiol, 1995. 42(4): p. 246-50.
43. Bevanger, L., A.I. Kvam, and J.A. Maeland, A Streptococcus agalactiae R protein analysed by polyclonal and monoclonal antibodies. Apmis, 1995. 103(10): p. 731-6.
44. Naess, A.I., et al., Evaluation of monoclonal antibodies in serovar classification of group B streptococci (GBS). Brief report. Apmis, 1991. 99(11): p. 1058-60.
45. Bevanger, L. and J.A. Maeland, Complete and incomplete Ibc protein fraction in group B streptococci. Acta Pathol Microbiol Scand B, 1979. 87b(1): p. 51-4.
46. Bevanger, L. and J.A. Maeland, Type classification of group B streptococci by the fluorescent antibody test. Acta Pathol Microbiol Scand B, 1977. 85b(6): p. 357-62.